源起基金关注领域——类器官行业(一)
一、类器官概述
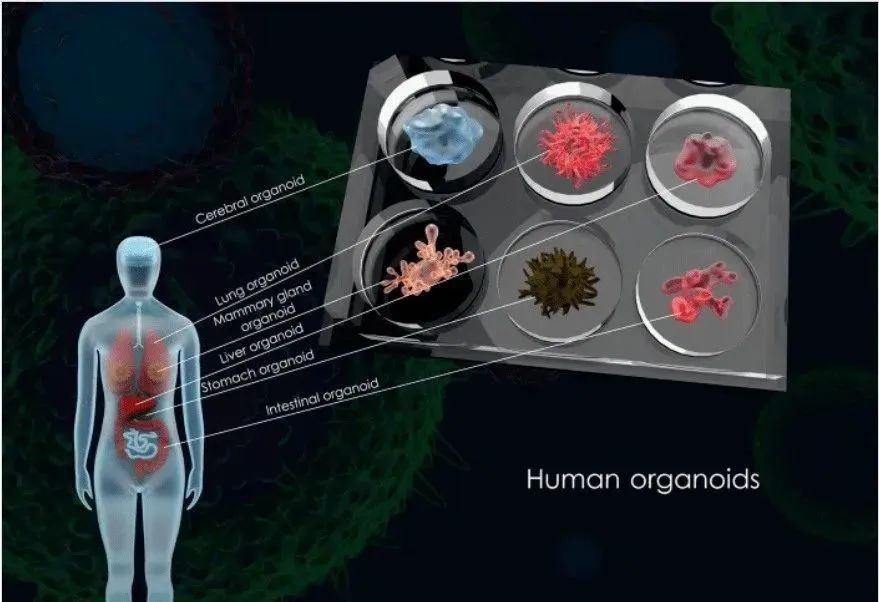
类器官指利用成体干细胞或多能干细胞进行体外三维培养而形成的,具有一定空间结构的组织类似物。类器官不是真正意义上的人体器官,但能在结构和功能上模拟真实组织器官,并能够长期稳定传代培养,因此也被称为“微型器官”。类器官具有稳定的表型和遗传学特征,在形成过程中再现了体内器官发生的两个事件,即同类细胞以黏附方式分类聚集和空间特异性的细胞谱系定型。
根据细胞来源不同,类器官分为两类,组织来源和多能干细胞来源,即成体干细胞(ASCs)、多能干细胞(PSCs)或人源肿瘤类器官(PDO),PSC又分为胚胎干细胞(ESC)和诱导多能干细胞(iPSC)。类器官拥有与来源组织一致的可自我更新的干细胞群,并且可通过使用含有特定细胞因子的培养基诱导干细胞扩增,从而实现类器官稳定传代和持续培养。不同类型的干细胞生物学特性有一定差异,故各类型类器官应用前景也有所不同:ESCs类器官可以模拟体内器官发育,在形态学特征研究及器官移植方面具有优势;iPSCs和ASCs类器官可在精准医疗、难治疾病建模及药物筛选领域发挥较大作用。
图|不同种类类器官形貌图
二、类器官应用
类器官包括多种细胞类型,更好地模拟了人体内细胞间、细胞与基质间的相互作用,从形态结构和表观遗传学方面都能很好地体现来源组织的特点,从而能更加仿真地了解人体内各种器官的生理病理机制,因此类器官在基础研究和临床诊疗研究中拥有广阔的应用前景,包括发育生物学、疾病病理学、细胞生物学、精准医学以及药物毒性和疗效测试。这项技术也为再生医学提供了巨大潜力,通过用类器官培养物替换受损或患病组织,为自体或异体细胞治疗提供了可能性。
将类器官技术应用于临床,指导临床用药和精准治疗是近期类器官技术的主要发展方向。2016年起,类器官技术被纳入临床试验中,截止到2020年9月,已有63项临床试验于FDA官方备案。中国国内2017年起注册且获伦理委员会批准的类器官临床试验研究有20项,涵盖8个癌种,主要关注化疗方法的疗效预测,也有研究开始关注免疫疗法在类器官中的应用(长海医院,PD-1)。从癌种分布看,目前国内研究癌种多为消化系统肿瘤、胰腺肿瘤、乳腺肿瘤。
三、类器官发展历程
2009年,荷兰科学家Hans Clevers团队成功将Lgr5+肠道干细胞在体外培养成具有隐窝状和绒毛状上皮区域的三维结构,也就是小肠类器官,使得类器官的研究翻开了快速发展的新篇章。2011年,日本RIKEN发育生物学中心成功将胚胎干细胞培养成视杯结构。随后,各国团队分别构建出肝芽、迷你肾和微型大脑结构。
图|类器官发展历程
2013年,类器官被Science评为年度十大技术。2014年,纪念斯隆凯特林癌症中心首次证实在实验室培养出人源的前列腺肿瘤类器官。2018年初,类器官被Nature Method评为2017年度最佳方法。目前,多种脏器类器官已被成功构建,其中包括小肠、胃、结肠、肺、膀胱、大脑、肝脏、胰腺、肾脏、卵巢、食道、心脏等,不仅包括正常器官组织类器官,还有相应肿瘤组织类器官,并在此基础上开展分子功能实验、药物筛选实验等。各病症的类器官培养成功率在70%-99%之间,其中培养成功率最高的为肠腺瘤、肠上皮、味蕾类器官。
2018年2月23日,《科学》杂志上发表了震惊世界的研究结果,在预测抗癌药物有效性和指导临床用药方面,与患者实际疗效进行对比,类器官有非常出色的预测性,达到100%的敏感性、93%的特异性、88%的阳性预测值以及100%的阴性预测值。
从PubMed搜索“Organoids”,涉及类器官技术文献数量从2009年的36篇,跃升到2021年的2836篇,其中不乏多篇CNS等各大顶级期刊文献,10余年间文章发表数量复合增速达到29%,中国发表的类器官文献数量在全球排名从第六位(2009-2019年)跃至第二位(2020年),仅次于美国。
图|2009-2021年类器官重要核心文献
根据clinicaltrials.gov的数据,自2016年起,类器官开始被纳入临床试验中,目前登记在clinicaltrails上有130起,其中肿瘤相关研究最多,达到110起,其次为消化系统相关疾病,达到44起。在全部临床试验中,已有20起地点在中国,约占15%。
免责声明:本公众号发布内容部分信息来源网络,本平台不对文章信息或资料真实性、有效性、准确性及完整性承担责任。文章仅供阅读参考,不作任何投资建议,如有侵权请联系删除。
